Atoms
Celestial Bodies
- Space Travel Equipment
- Stars
- Rotation and Revolution
- Relation Between Escape Velocity And Orbital Velocity
- Dwarf Planets
- Difference Between Solar Eclipse And Lunar Eclipse
- Difference Between Equinox And Solstice
- The Escape Velocity Of Earth
- Solar System
- Difference Between Stars And Planets
- Difference Between Asteroid And Meteoroid
- Constellations
Circuits
电路 (diàn lù)
电路 (Diànlù)
电路
通信系统Pdf
二极管
地球科学
电荷
电
- 类型的齿轮
- 电子产品在日常生活中
- 类型的汽车
- 类型的直流电机
- 类型的交流电机
- 晶体管工作
- 转矩电流环
- 电动机
- 电阻温度依赖性
- Rms值交流电
- 电抗和阻抗
- 相量表示法交流
- 平行板电容器
- 焦耳定律
- 电力
- 磁场对载流导线的影响
- 电流密度
- 导体绝缘体
- 导电
- 碳电阻器
- 直流发电机
- 类型的发电机
- 类型的电流
- 直流发电机类型
- Torque On Dipole
- 电流的热效应
- 电动发电机
- 静电
- 电阻率不同的材料
- 电场的物理意义
- 介电常数和磁导率
- 电能和权力
- 电流在导体
- 电动汽车
- 位移电流
- 电阻与电阻率之间的差异
- 电动机和发电机之间的区别
- 接地和接地之间的区别
- 电流线圈
- 水的电导率
- 导电的液体
Electricity
电磁波
电磁
静电学
能量
- 能量
- 能源类型
- 热能
- 太阳能项目
- 太阳能汽车
- Ev和Joule之间的关系
- 动能和完成的功
- 能量转换
- 一维和二维的弹性和非弹性碰撞
- 常规能源和非常规能源
- 太阳能炊具
- 潮汐能
- 能源
- 太阳能和光伏电池
- 动能与动量的关系
- 热量与焦耳的关系
- 能源及其对环境的影响
- 能源考虑
流体
武力
Force
摩擦
万有引力
热
动力学理论
光
- 镜面反射漫反射
- 人眼
- 结构人眼功能
- 阴影的形成
- 反射和折射之间的区别
- 相干源
- 光的透射、吸收和反射
- 透明半透明和不透明
- 阳光白色
- 单狭缝衍射
- 拉曼散射
- 粒子自然光光子
- 真实图像与虚拟图像的区别
- 衍射和干涉的区别
磁性
运动
- 运输历史记录
- 速度-时间图
- 旋转动能
- 刚体和刚体动力学
- 扭矩和速度之间的关系
- 粒子的直线运动
- 周期性运动
- 动量和惯性之间的差异
- 动量守恒
- 运动测量类型
- 扭矩
- 慢速和快速运动
- 滚动
- 刚体平移运动和旋转运动
- 相对速度
- 径向加速度
- 速度和速度之间的区别
- 动力学和运动学的区别
- 连续性方程
- 线性动量守恒
自然资源
核物理学
光学
Optics
- Reflection of Light and Laws of Reflection
- Concave Lens
- Total Internal Reflection
- Thin Lens Formula For Concave And Convex Lenses
- Spherical Mirror Formula
- Resolving Power Of Microscopes And Telescopes
- Refractive Index
- Refraction Of Light
- Refraction Light Glass Prism
- Reflection On A Plane Mirror
- Reflection Lateral Inversion
- Rainbow
- Photometry
- Difference Between Simple And Compound Microscope
- Difference Between Light Microscope And Electron Microscope
- Concave Convex Mirror
- Toric Lens
- The Lens Makers Formula
- Simple Microscope
Oscillation
Pressure
- Thrust Pressure
- Relation Between Bar And Pascal
- Regelation
- Sphygmomanometer
- Relation Between Bar And Atm
- Difference Between Stress And Pressure
Quantum physics
- Quantum physics
- Rydberg Constant
- Electron Spin
- Casimir Effect
- Relativity
- Quantum Mechanics
- Electrons And Photons
Radioactivity
- Relation Between Beta And Gamma Function
- Radioactivity Beta Decay
- Radioactive Decay
- Stefan Boltzmann Constant
- Radioactivity Gamma Decay
- Radioactivity Alpha Decay
- Radiation Detector
Scalars and Vectors
- Scalars and Vectors
- Triangle Law Of Vector Addition
- Scalar Product
- Scalar And Vector Products
- Difference Between Scalar And Vector
Scientific Method
- Scientific Methods
- Safety Measures Technology
- Difference Between Science And Technology
- Scientific Investigation
Semiconductors
- Semiconductor Devices
- Junction Transistor
- Semiconductor Diode
- Difference Between Npn And Pnp Transistor
Solid Deformation
- Solid State Physics
- Solid Deformation
- Stress
- Shear Modulus Elastic Moduli
- Relation Between Elastic Constants
- Elastic Behavior Of Solids
- Tensile Stress
- Stress And Strain
- Shearing Stress
- Elastomers
- Elastic Behaviour Of Materials
- Bulk Modulus Of Elasticity Definition Formula
Sound
- Sound waves
- Timbre
- Speed Of Sound Propagation
- Sound Waves Need Medium Propagation
- Sound Reflection
- Sound Produced Humans
- Doppler Shift
- Difference Between Sound Noise Music
- The Human Voice How Do Humans Create Sound With Their Vocal Cord
- Sound Vibration Propagation Of Sound
- Sound Produced Vibration Object
- Reverberation
- Doppler Effect
System of Particles and Rotational Dynamics
Thermal Properties of Matter
- Thermal Properties of Materials
- Thermal Stress
- Thermal Expansion Of Solids
- Thermal Conductivity Of Metals
Thermodynamics
- Statistical Physics
- SI Units List
- Statistical Mechanics
- Reversible Irreversible Processes
- Carnots Theorem
- Temperature
- Kelvin Planck Statement
- Difference between Isothermal and Adiabatic Processes
Units and measurements
- Density of Air
- The Idea Of Time
- Difference Between Pound And Kilogram
- Difference Between Mass And Volume
- Dimensional Analysis
- Density Of Water
- Time Measurement
- Standard Measurement Units
- Relation Between Kg And Newton
- Relation Between Density And Temperature
- Difference Between Mass And Weight
Waves
- Space Wave Propagation
- Sharpness Of Resonance
- Relation Between Group Velocity And Phase Velocity
- Relation Between Amplitude And Frequency
- Periodic Function
- P Wave
- Destructive Interference
- Transverse Waves
- Travelling Wave
- Standing Wave Normal Mode
- S Waves
- Relation Between Frequency And Velocity
- Reflection Of Waves
- Phase Angle
- Period Angular Frequency
Work, Energy and Power
- Derivation Of Work Energy Theorem
- Conservation Of Mechanical Energy
- Relation Between Work And Energy
- Destruction Caused Cyclones
Physics Experiments
- Determine Resistance Plotting Graph Potential Difference versus Current
- To find the weight of a given Body using Parallelogram Law of Vectors
- To study the variation in volume with pressure for a sample of air at constant temperature by plotting graphs between p and v
- To measure the thickness of sheet using Screw Gauge
- To find the value of V for different U values of Concave Mirror find Focal Length
- To find the Surface Tension of Water by Capillary Rise Method
- To find the Resistance of given wire using Metre Bridge and hence determine the Resistivity of its Material Experiment
- Determine Mass of Two Different Objects Using Beam Balance
- Tracing the path of the rays of light through a glass Prism
- Tracing path of a ray of light passing through a glass slab
- Tornado Bottle
- To find image distance for varying object distances of a convex lens with ray diagrams
- To find force constant of helical spring by plotting a graph between load and extension
- To find focal length of concave lens using convex lens
- To find effective length of seconds pendulum using graph
- To find downward force along inclined plane on a roller due to gravitational pull of the earth and its relationship with the angle of inclination
- To draw the IV characteristic curve for p n junction in forward and reverse bias
- To determine Young’s modulus of elasticity of the material of a given wire
- To determine the internal resistance of a given primary cell using a potentiometer experiment
- To determine the coefficient of viscosity of given viscous liquid by measuring terminal velocity of given spherical body
- To determine specific heat capacity of given solid by method of mixtures
- To determine radius of curvature of a given spherical surface by a Spherometer
- Scope and Excitement of Physics
- Rocket science
- Relationship between frequency and length of wire under constant tension using Sonometer
- To determine equivalent resistance of resistors when connected in series and in parallel
- To convert the given galvanometer of known resistance and figure of merit into a voltmeter of desired range and to verify the same experiment
- To determine minimum deviation for given prism by plotting graph between angle of incidence and angle of deviation
- To compare the emf of two given primary cells using potentiometer experiment
Introduction
物质有五种状态,气体就是其中之一。空的空间充满了气体。大气中充满了气体分子。它含有不同的气体分子。呼吸所需的氧气分子与许多其他气体分子一起也在我们的大气层中。宇宙中的每一种物质都是由称为分子的微小粒子组成的。它们以某种吸引力相互吸引。分子之间存在分子间的吸引力。
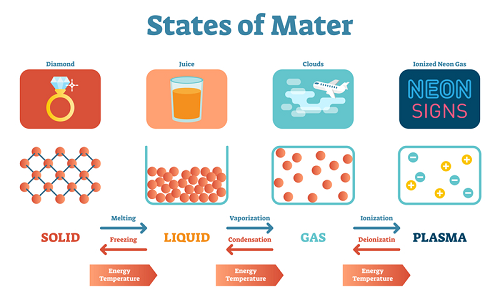
根据分子之间的吸引力,物质分为五类。它们是固体、液体、气体、等离子体和玻色-爱因斯坦。固体是指分子之间的距离很小并且彼此紧密结合的物质。液体是分子距离很小的物质,它们的结合不如固体紧密。等离子体态分子具有高动能。
Assumptions of Kinetic Theory of Gases
气体的动力学理论显示了气体的热力学行为。他们有一些基本假设,
气体中有许多被称为粒子的微小粒子。
它们相互之间以及与容器的壁发生弹性碰撞。
粒子彼此相同,可以在所有可能的方向上移动。
与碰撞之间的时间相比,碰撞的时间非常小。
与气体的总体积相比,分子的体积要小得多。
分子不会对另一个施加任何力,除非在碰撞过程中。
与分子的大小相比,分子之间的分离更大。
所有的分子都服从运动定律。
What do you mean by Kinetic Interpretation of Temperature ?
让我们考虑体积为V的充气容器。让分子以所有可能的速度运动。然后,由气体分子施加在壁上的压力由,
$mathrm{P=frac{1}{3}frac{mnc^2}{v}}$
其中m表示一个分子的质量。n表示分子的数量$mathrm{C^2}$表示分子的均方根速度。V表示气体的体积。
1摩尔的气体含有N个分子。
$mathrm{PV=frac{1}{3}mNC^2}$
根据气体定律PV=RT
$mathrm{RT=frac{1}{3}mNC^2}$
$mathrm{frac{RT}{N}=frac{1}{3}mC^2}$
将右边乘以2,我们得到,
$mathrm{frac{RT}{N}=frac{2}{3} imes frac{1}{2} mC^2}$
分子的动能为$mathrm{K.E=frac{1}{2}mC^2}$
$mathrm{frac{RT}{N}=frac{2}{3} imes K.E}$
$mathrm{K.E=frac{3}{2} imes frac{RT}{N}}$
$mathrm{K.E=frac{3}{2} KT}$
其中$mathrm{K=frac{R}{N}}$表示玻尔兹曼常数。
Relation between Kinetic Energy and Temperature
对身体所做的工作就是它的能量。由于运动而拥有能量的物体称为动能。它可以从一个物体转化为另一个物体,也可以转化为其他形式的能量。这个能量取决于它的质量和速度。动能的S。I单位是焦耳。因此,物体的动能由,
$mathrm{K.E=frac{1}{2} mc^2}$
分子的自由度因能量均分定律而不同;系统的总能量被平均分配给分子的每个自由度。平均分配的能量是1/2 kT,这就是能量均分定律。因此,气体的温度与分子的动能直接相关。
Gas laws
为了了解气体的行为,人们提出了许多法律。气体定律给出了压力、温度和体积之间的关系。它们是查理定律、盖伊·卢萨克定律、阿伏伽德罗定律、波义耳定律和格拉姆定律。
博伊尔定律:博伊尔定律清楚地表明,气体的压力与气体的体积是有争议的。(即)当压力增加时,体积将减小。只要温度恒定,这种情况就会一直保持下去。数学表示给出,
$mathrm{P varpropto frac{1}{v}}$
$mathrm{PV = k:(constant)}$
查理定律:当温度升高时,气体会膨胀。这可以用查理定律来解释。结果表明,当压力保持不变时,气体的体积直接随温度的变化而变化。
$mathrm{V varpropto T}$
$mathrm{frac{v}{T} = k(constant)}$
Gay-Lussac定律:当气体体积保持不变时,气体的压力直接随着温度的变化而变化。这就是众所周知的盖伊·卢萨克定律。
$mathrm{P varpropto T}$
$mathrm{frac{P}{T} = k(constant)}$
阿伏伽德罗定律:阿伏伽dro定律说,在相同体积的气体中,当相同的温度和压力相同时,分子的数量将相同。
$mathrm{V varpropto n}$
$mathrm{frac{v}{n} = k}$
格雷厄姆定律:根据他的原理,较轻的分子比较重的分子移动得更快。即,在恒定的压力和温度下,低分子质量的分子的渗出速度比高分子质量的分子更快。分子随时间的扩散是其质量密度平方根的倒数。
$mathrm{r varpropto frac{1}{sqrt{P}}}$
Conclusion
在本教程中,详细讨论了气体动力学理论的假设和温度的动力学解释。还讨论了动能与温度和气体定律之间的关系。
FAQs
问题1.解释自由度
答:分子提及其位置所需的数字坐标称为自由度。一般来说,单原子分子有三个自由度。具有一个以上原子的分子包括另外三个自由度,如平移运动、旋转运动和振动运动。根据这个自由度,具有一个以上原子的分子将发生变化。
Q2.状态是指气体中的自由路径
答:在气体中,分子相互碰撞,也与容器壁碰撞。分子在任意两次连续碰撞之间行进的距离的平均值被称为平均自由程。用λ表示。
Q3.影响气体行为的因素是什么
答:影响气体行为的因素有温度(T)、压力(P)、体积和数量。如果气体的温度升高,气体就会膨胀,从而体积增加。类似地,随着温度的降低,体积也由于气体分子的压缩而减小。温度的升高导致气体膨胀,因此其压力增加,反之亦然。要将气体转化为固体或液体,温度必须非常低。数量和压力成正比。由于压力与体积和数量成正比,因此通过使体积和数量变高来增加压力。
Q4.列出气体定律的一些应用
答:如果环境条件发生变化,那么气体分子的行为就会偏离它们的行为。气体定律可以很好地研究这些变化。用于吸入液体的注射器是根据波义耳定律原理设计的。蛋糕和面包在加热时的膨胀符合查理定律。它也被用于天气预报系统。它们也用于热力学和流体动力学。
问题5.气体是如何被压缩的
答:气体是物质的一种状态,在这种状态下分子是松散结合的。所以分子之间有很多间隙。当对气体施加压力时,间隙会减小,颗粒会越来越近。从而体积减小并且气体被压缩。
